
Le Gecko


Comment le gecko fait-il pour adhérer à toutes les surfaces ?
Les forces de Van der Waals
Les forces de van der Waals sont définies comme une interaction électrique d'intensité faible à courte distance entre et/ou molécules. Ces forces portent le nom du physicien et mathématicien Johannes Diderik van der Waals, ses travaux sur la continuité des états fluides, notamment de l'état liquide et gazeux lui ont permis de découvrir les forces de van der Waals, et d'exprimer la compressibilité des gaz à diverses températures. Il est lauréat du prix nobel de physique en 1910.
Les forces de Van der Waals ont trois différentes origines :
-les forces de Keesom
-les forces de Debye
-les forces de London
L'énergie des forces de van der Waals peut donc se formuler de la façon suivante :


Les forces de Keesom
Les forces de Keesom ont été nommées en l'honneur de Willem Hendrik Keesom qui fut le premier à fournir leur formulation mathématique en 1912.
Ce sont des interactions entre dipôles électriques permanents et ont donc lieu avec des molécules polaires. Elles sont donc en lien avec l'électronégativité. Pour les forces de Keesom, l'énergie d'interaction n'est efficace qu'à courte distance.
L'énergie des forces de Keesom se formule comme ceci :

Dans cet expression :
-U1 et U2 sont deux dipôles permanents éloignés d'une distance moyenne r
-E0 correspond à la constante diélectrique du vide (8,854.10−12 C2.J−1.m−1)
-KB est la constante de Boltzmann
-T correspond à la température absolue
L’expression de l’énergie de Keesom nous montre que cette dernière dépend de l’interaction entre les dipôles électriques permanents mais également de la température. La force de Keesom est d’autant plus forte, que les dipôles permanents sont grands et alignés, et, que la température est basse.
Les forces de Debye
Les forces de Debye proviennent de l'interaction entre un dipôle permanent et un dipôle induit. Cette intéraction a donc lieu entre une molécule polaire et une autre qui peut être soit polaire, soit apolaire. Tous les atomes et molécules sont polarisables grâce à la déformation du nuage électrique suite à la présence d'un champ électrique.
On peut schématiser l'interaction de Debye par :

Ce schéma montre comment, par rapprochement, on obtient une molécule polaire sur une molécule apolaire.
L'énergie de cette interaction se formule comme ceci :

L'énergie de cette interaction est donc proportionnelle au dipôle pérmanent de la molécule polaire ainsi qu'à la polarisabilité (α) de la molécule apolaire. Plus la polarisabilité et le dipôle permanent sont grands, plus l'énergie sera grande. Cette énergie s'exprime en kJ/mol.
Les forces de London
Les forces de London sont des forces faibles intermoléculaires créées par des dipôles induits. Un dipôle induit est créé par une répartition inhomogène du nuage électronique dans la molécule, ce dipôle va lui-même créer un dipôle induit sur la molécule voisine comme le montre ce schéma :
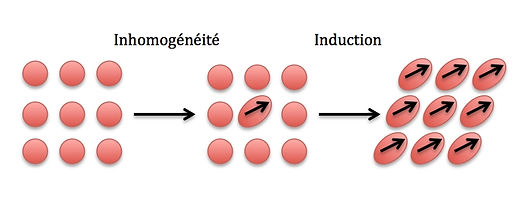
Cette interaction peut donc avoir lieu entre une molécule polaire/apolaire et une molécule polaire/apolaire mais elle est prépondérante quand elle a lieu entre molécules apolaires.
L'énergie de cette interaction se formule comme ceci :

Comme le montre cette expression, l'énergie due à l'interaction de London est proportionnelle aux polarisabilités des molécules (α)